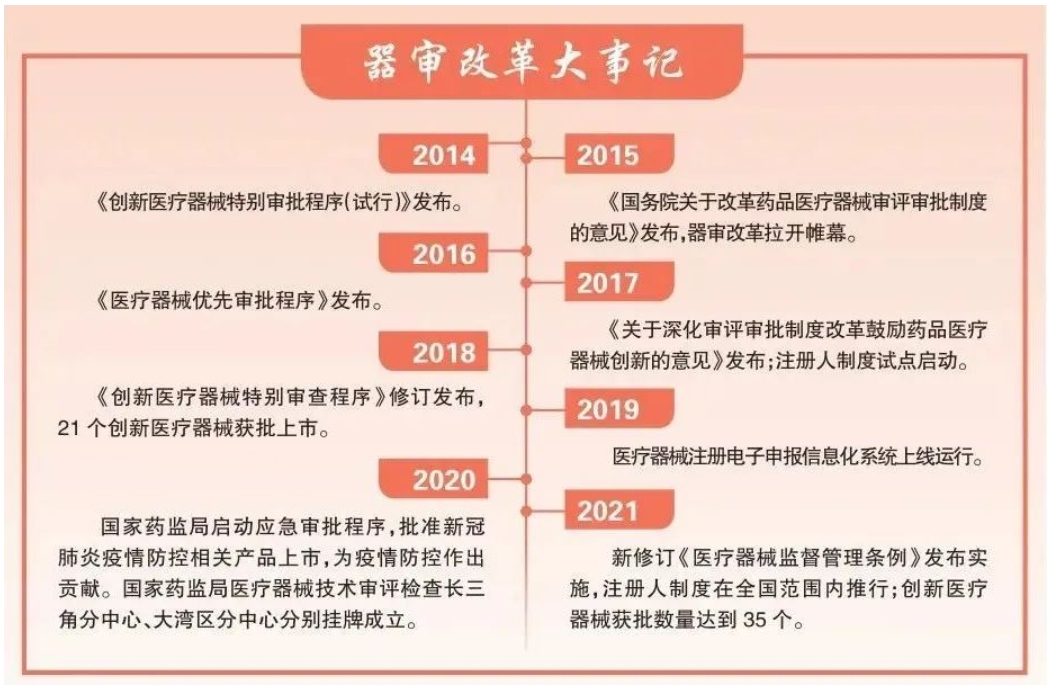
黨的十八大以來,醫療器械審評審批制度改革持續激發創新潛能和活力,醫療器械產業發生了翻天覆地的變化,我國部分高端醫療器械實現從跟跑、并跑到領跑的跨越,醫療器械產業發展駛入“快車道”,創新成為行業“主旋律”。
2022年6月,《支持港澳醫療器械注冊人在大灣區內地9市生產醫療器械實施方案》發布,明確港澳醫療器械注冊人獲得國家藥監局發放的醫療器械注冊證后,可以委托粵港澳大灣區內地9市符合條件的企業生產,進一步推動粵港澳大灣區生物醫藥產業深度融合,實現粵港澳大灣區醫藥產業共同發展。
2023年5月,粵港澳大灣區藥品醫療器械創新網發展論壇在澳門舉行。論壇提及截至2023年4月,已有10個香港、澳門生產的傳統外用中成藥通過簡化審批在內地上市;通過“港澳藥械通”政策累計批準急需進口藥品23個,醫療器械13個,極大滿足了大灣區人民多種醫療需求。
2023年7月11日,國家藥品監督管理局召開創新醫療器械報告會,提及截至目前,已批準217個創新醫療器械產品,涵蓋重離子治療系統、質子治療系統、手術機器人、人工血管等諸多高端醫療器械,部分產品接近或者達到國際先進水平,臨床應用價值顯著,填補了我國相關領域空白。
近年來,國家藥監局持續完善法規制度體系,出臺促進產業高質量發展規劃,強化與有關部門合作,創新審查機制,啟動實施監管科學行動計劃,拓展監管國際交流與合作,不斷推動產業創新高質量發展。
國家藥監局制定并實施創新醫療器械特別審批程序,加快創新器械的注冊速度。具有我國發明專利,在技術上屬于國內首創,而且在國際領先,具有顯著臨床應用價值的醫療器械進入特別審批通道,進行優先審批。進入這個通道以后,主要采取早期介入、專人負責、全程指導,在標準不降低、程序不減少的情況下予以優先審評審批,審評審批時間較其他產品平均縮短83天。
其中,境內申請人應當向其所在地的省級藥品監督管理部門提出創新醫療器械特別審查申請;境外申請人應當向國家藥品監督管理局提出創新醫療器械特別審查申請。
2023年8月14日,上海市為支持創新醫療器械在醫療機構開展應用示范,形成“應用示范-反饋改進-水平提升-輻射推廣”的創新迭代,提高本市創新醫療器械性能質量,推動產業高質量發展發布了《關于開展2023年上海市創新醫療器械應用示范項目申報的通知》。申報主體由醫療機構與生產企業組成“1+N+1”聯合體共同申報。
1.植介入器械;2.體外診斷儀器和試劑;3.醫用成像器械;4.手術器械;5.治療器械;6.診察監護器械;7.康復器械;8.婦產科、輔助生殖器械;9.醫用軟件;10.其他醫療器械。
《通知》中配套支持方面提及,對于列入應用示范項目的創新醫療器械、參與示范項目的單位,在申報高質量發展專項、申請配置相關設施設備、申請相關收費項目和納入醫保支付時予以優先支持。在國家或本市重點項目推介、金融支持、對外合作、宣傳推廣等方面予以優先支持。
2023年10月27日,北京市藥品監督管理局印發《醫療器械創新網服務提質增效行動方案(2023-2025年)》(京藥監發〔2023〕234號),文件針對第二、三類醫療器械審評審批相關要求以及創新驅動發展方向進行相關指導。
文件針對第二、三類器械在未來兩個年度相關審評、審查、審批時間進行了細致要求,大大縮短了相關產品的過審時間,具體信息統計如下:
醫療器械中,第二類創新和優先審批產品的審查、審評、審批所需天數在未來兩個年度內均有著明顯的下降。其中,注冊技術審評天數更是從當下的120天大幅縮減至20天,降幅超過80%。過審時間的大幅縮減,表明政府對醫療器械創新網發展的大力支持,在政務上為醫療器械的創新“保駕護航”!
2022年,國家藥監局按程序做好創新醫療器械、臨床急需醫療器械審評審批,高端醫療裝備國產化有新突破,批準首個國產質子治療系統等創新醫療器械55個(總數為189個),優先審批醫療器械77個(總數為126個),創新醫療器械獲批數量與2021年相比增加57.1%,更好地滿足人民群眾使用高水平醫療器械需要。
從2014年至2022年,國家藥監局共批準189個創新醫療器械。其中,境內創新醫療器械涉及15個省的134家企業,進口創新醫療器械涉及2個國家的8個企業。北京、上海、廣東、江蘇、浙江創新醫療器械獲批產品數量和相應企業數量最多,約占全部已批準的189個創新醫療器械的82.5%。
截至2023年11月13日,國家藥監局已批準的創新醫療器械共計236個,其中2023年批準創新醫療器械47個。具體名錄如下:
創新醫療器械審查程序和要求的規范,審查質量和效率的提升,醫療器械注冊人制度,全生命周期監管理念等政策舉措,為醫療器械創新網發展提供了更加堅實的保障。中國醫療器械產業,正步履堅定,向“新”而行。
