
12月1日,國家藥監(jiān)局發(fā)布《抗腫瘤藥物的非原研伴隨診斷試劑臨床試驗注冊審查指導(dǎo)原則》《使用體外診斷試劑境外臨床試驗數(shù)據(jù)的注冊審查指導(dǎo)原則》以及《神經(jīng)和心血管手術(shù)器械-刀、剪及針注冊審查指導(dǎo)原則》。
01/抗腫瘤藥物的非原研伴隨診斷試劑臨床試驗注冊審查指導(dǎo)原則

伴隨診斷試劑臨床試驗?zāi)康闹饕瑑蓚€方面,一方面為確認試劑臨床性能,另一方面為確認伴隨診斷用途。根據(jù)伴隨診斷試劑設(shè)計開發(fā)的特點,確認其伴隨診斷用途的臨床研究可分為如下幾種情況:
(一)如為原研伴隨診斷試劑,可提交該產(chǎn)品作為伴隨診斷試劑參與的藥物臨床試驗資料作為確認伴隨診斷用途的臨床試驗資料,或提交與藥物臨床試驗中所使用的CTA進行橋接試驗的臨床試驗資料。具體可參考與抗腫瘤藥物同步研發(fā)的原研伴隨診斷試劑臨床試驗的相關(guān)要求。
(二)申報產(chǎn)品如為非原研伴隨診斷試劑,其伴隨診斷用途可根據(jù)具體情形采用下列適用的方式之一進行研究:與原研伴隨診斷試劑進行一致性比對、橋接試驗、已上市抗腫瘤藥物療效的觀察性研究。
針對所伴隨的抗腫瘤藥物已上市多年、臨床應(yīng)用廣泛、意義明確、判讀易于標準化的伴隨診斷試劑,如申報產(chǎn)品的性能與原研伴隨診斷試劑具有較好的可比性,則申報產(chǎn)品伴隨診斷用途的確認可采取與原研伴隨診斷試劑進行一致性比對的方式,此類生物標志物清單見表1。申請人擬開發(fā)的未包含在表1中的生物標志物,如有需要可與監(jiān)管部門充分溝通后確定其伴隨診斷臨床意義。
申報產(chǎn)品所檢測的生物標志物中存在針對抗腫瘤藥物療效負性選擇的生物標志物。例如RAS基因,已批準的西妥昔單抗說明書中明確載明,該藥物不用于RAS基因的突變的結(jié)直腸癌患者。針對此類生物標志物,申報產(chǎn)品伴隨診斷用途的確認可采取與原研伴隨診斷試劑或CTA進行一致性比對的方式,臨床試驗應(yīng)重點關(guān)注二者的一致性。
表1.相關(guān)生物標志物清單
注:基于當前認知及我國相關(guān)產(chǎn)品的開發(fā)及臨床應(yīng)用情況,相關(guān)抗腫瘤藥物已上市、臨床應(yīng)用廣泛、意義明確、判讀易于標準化并且臨床應(yīng)用多年的伴隨診斷生物標志物清單見表1。該清單會隨著科學認知的深入及相關(guān)產(chǎn)品的臨床應(yīng)用情況適時更新。
02/使用體外診斷試劑境外臨床試驗數(shù)據(jù)的注冊審查指導(dǎo)原則
本指導(dǎo)原則旨在為申請人使用體外診斷試劑境外臨床試驗數(shù)據(jù)在我國進行注冊申報提供指導(dǎo),適用于進行首次注冊申報和相關(guān)變更注冊申請的產(chǎn)品。
本指導(dǎo)原則聲稱的境外臨床試驗數(shù)據(jù)是指,全部或同期在境外具備臨床試驗開展所在國家(地區(qū))要求條件的臨床試驗機構(gòu)中,對擬在我國注冊申報的體外診斷試劑進行臨床試驗時所產(chǎn)生的研究數(shù)據(jù)。
差異分析導(dǎo)圖
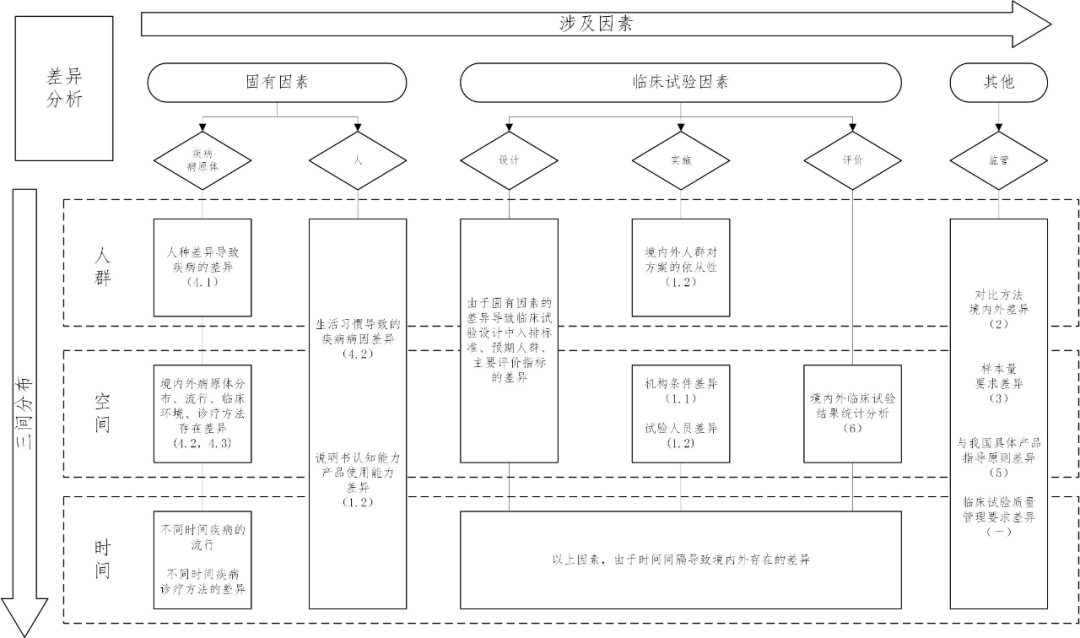
注:1.圖中每部分內(nèi)容均不是對該部分內(nèi)容的窮舉,應(yīng)當根據(jù)產(chǎn)品的特性對境內(nèi)外的差異進行具體分析。
2.不同因素、三間分布之間可能存在交叉。
3.表格主要以“(二)境內(nèi)外臨床試驗設(shè)計關(guān)鍵要素的差異分析”章節(jié)為基礎(chǔ)。
03/神經(jīng)和心血管手術(shù)器械-刀、剪及針注冊審查指導(dǎo)原則
本指導(dǎo)原則適用于第二類神經(jīng)和心血管無源手術(shù)器械中的手術(shù)刀、手術(shù)剪及手術(shù)針。
產(chǎn)品技術(shù)要求
產(chǎn)品技術(shù)要求的制定應(yīng)符合《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指南》的要求。注冊申請人需根據(jù)產(chǎn)品的技術(shù)特征和臨床使用情況來確定產(chǎn)品的性能指標和檢驗方法。對注冊申請人宣稱的產(chǎn)品的所有技術(shù)參數(shù)和功能,若適宜,均需在產(chǎn)品技術(shù)要求中予以規(guī)定。產(chǎn)品技術(shù)要求中的試驗方法均需為已經(jīng)過驗證的方法。若對標準中的試驗方法有所修改,需明確修改的內(nèi)容和原因,并在研究資料中提供驗證資料。對于相關(guān)行業(yè)標注、國家標準中不適用的要求條款,需說明不適用的原因和依據(jù)。
(1)產(chǎn)品型號/規(guī)格及其劃分的說明
列表說明產(chǎn)品的型號、規(guī)格,明確產(chǎn)品的型號、規(guī)格的劃分說明,鑒于該類器械型號、規(guī)格較多,建議在附錄中以列表的形式提供,列表中需明確具體組件的種類和數(shù)量。
(2)性能指標
產(chǎn)品性能研究項目中,對于可進行客觀判定的成品的功能性、安全性指標,需將其列入產(chǎn)品技術(shù)要求。可包括但不限于以下性能:外觀、尺寸、硬度、表面粗糙度、耐腐蝕性能、連接牢固度(適用于有連接部件的產(chǎn)品)、使用性能(可客觀判斷的性能,如刀片刃口鋒利度、手術(shù)剪的剪切性能等)、環(huán)氧乙烷殘留量(適用于環(huán)氧乙烷滅菌的產(chǎn)品)、無菌(適用于滅菌狀態(tài)交付的產(chǎn)品)。
(3)檢驗方法
產(chǎn)品的檢驗方法需根據(jù)性能指標設(shè)定,檢驗方法需優(yōu)先采用公認的或已頒布的標準檢驗方法;自建檢驗方法需提供相應(yīng)的方法學依據(jù)和理論基礎(chǔ),同時保證檢驗方法具有可操作性和可重現(xiàn)性,必要時可附相應(yīng)圖示進行說明,文本較大的可以附錄形式提供。
(4)附錄
建議注冊申請人以資料性附錄形式提供產(chǎn)品的結(jié)構(gòu)圖示及制造材料信息。